La corrosión, el talón de Aquiles de los metales…
Todos los metales que forman parte de nuestra embarcación están sometidos de alguna forma u otra a los efectos de la corrosión. Conocer las causas que la generan, así como minimizar sus consecuencias, es imprescindible para evitar desembolsos económicos innecesarios al tener que reparar los graves daños que se pueden originar.
Hélice completamente destrozada por la corrosión
En ocasiones se generalizan expresiones y conceptos inadecuados acerca del deterioro de los metales. A continución intentaré explica de modo general por qué se deterioran los metales,`por lo que distinguiremos tres tipos de corrosión: por oxidación, galvánica y electrolítica.
Corrosión por oxidación:
Podemos definirla como el proceso químico por el cual los metales tienden a volver a su forma más estable. El acero, por ejemplo, esta compuesto principalmente de hierro y carbono, este hierro lo encontramos en la naturaleza en forma de óxido de hierro, por lo que el hierro que compone el acero, al estar en contacto con el oxígeno del aire o del agua, tenderá a combinarse con él para volver a su estado primitivo, óxido de hierro.
Para evitar este tipo de oxidación, debemos aislar el acero del aire o del agua mediante pinturas para tal fin. Esto tiene mucho sentido en un barco cuyo casco sea de acero, pero no para nuestro caso, el más frecuente con embarcaciones deportivas de fibra de vidrio, en donde los elementos de acero que se presentan en la obra muerta son minimos, recurriendo al acero inoxidable 316 para uso marino. El cromo, el níquel y el molibdeno son algunos de los metales que componen dicho acero y que le confieren esa propiedad, ser inoxidable. Un buen acero inoxidable, que haya sido pulido eficientemente, sólo presentará, con el paso del tiempo, pequeños puntos de oxidación en aquellos lugares en donde se haya rayado o golpeado, ya sea por un elemento externo como al ensamblarse las diferentes piezas que lo componen. Esta mancha de óxido es tan fina que con cualquier producto quita-óxido desaparecerá inmediatamente.
Casco de alumino afectado por la corrosión
En el caso del alumino, lo que ocurre es que el óxido de alumnio protege al propio alumnio. Cuando éste es arañado, se forma una película de óxido de aluminio que es muy dura y que impide que el aire vuelva a estar en contacto con el metal, se puede decir que el alumnio es inoxidable.
Corrosión galvánica:
A diferencia de la oxidación, la corrosión galvánica es un proceso electroquímico en el que intervienen dos metales.
En el año 1761, la Armada británica realizó un experimento en su fragata HMS «Alarm» para intentar paliar los efectos que producía el gusano de la madera sobre los cascos de la flota. El teredo actuaba de forma implacable, y las constantes reparaciones de las carenas suponían un enorme coste para la Armada. El experimento consistía en cubrir toda la obra viva del barco con planchas de cobre, de esta forma, se quería impedir la entrada del gusano, ademas de mejorar el deslizamiento del casco; el cobre, al ser un material con un acabado mas liso que la madera, producía menos fricción e impedía las incrustaciones en mayor medida por ser altamente tóxico. En 1763, para comprobar los resultados del experimento, vararon el barco; el gusano no había penetrado en la madera, pero se dieron cuenta de que el forro se había separado en muchas partes del casco porque los clavos de hierro que lo fijaban a la madera se habían corroido enormemente, una inspección más cercana reveló que algunos de los clavos sufrieron una corrosión menor debido a que habían atrapado parte del papel con que venían forradas las planchas de cobre del astillero, ya que algunas de estas planchas se ahbían fijado sin quitarles el papel. El informe que posteriormente se escribió, decía que el cobre y el hierro, sumergidos en agua de mar, no podían estar en contacto directo ya que el cobre hacía que el hierro se corroyera.
Instalación de ánodos de sacrificio
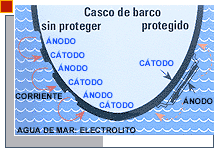
Los metales, dependiendo de su estructura atómica, tienen un potencial u otro, que hace que tiendan a perder o ganar electrones; este potencial se mide en voltios, y podemos establecer una lista en donde los metales que están en primer lugar de la serie galvánica son los metales nobles o negativos, con tendencia a ganar electrones, y los metales que estan en último lugar son los metales básicos o positivos, con tendencia a perder electrones.
Para que la corrosión galvánica se produzca deben ocurrir dos cosas: primero, que dos metales con diferente potencial se pongan en contacto, ya sea juntándolos o a través de un conductor, y segundo, que estén sumergidos en un electrolito, que es simplemente una solución de agua y sales que permite el paso de la corriente entre los metales. El agua de mar es uno de los mejores electrolitos que hay debido a la gran cantidad de sales que contiene. Una vez que se cumplen las condiciones, lo que ocurre es que la corriente circula desde el metal de menor potencial, al que llamamos ánodo, al de mayor potencial, al que llamamos cátodo, asimismo, parte del material del ánodo marcha al cátodo a través de los iones del electrolito, perdiendo su masa y degradandose progresivamente.
Serie galvánica (de mayor a menor): Platino, oro, grafito, titanio, plata, níquel, bronce, latón, cobre, estaño, plomo, acero inoxidable, hierro de fundición, acero galvanizado, aleaciones de alumnio, zinc, magnesio y aleaciones de magnesio.
Protección contra la corrosión galvánica:
La protección más usual contra la corrosión galvánica es la utilización de ánodos de sacrificio, es decir, la utilización de metales que estén siempre por debajo de los metales a proteger en la serie galvánica. La unión más típica que se presenta en nuestras embarcaciones es la unión de acero inoxidable con bronce, como por ejemplo el ensamblaje de la hélice de bronce con el eje de acero inoxidable; si miramos la serie galvánica, vemos que el bronce esta por encima del acero inoxidable, con lo que en el par galvánico que se forma, el eje perderá masa y se corroerá. Lo que se hace es adosar un metal que este por debajo de éstos en la escala para scrificarlo en beneficio del acero. Frente al alumnio o al magnesio, en agua de mar se opta por el zinc, ya que es un material muy maleable; si estamos en agua dulce, el magnesio seerá mejor, ya que debemos compensar la «falta de sales» con una mayor diferencia de potencial entre los metales.
Reparación de un casco
La otra forma de impedir que dos metales formen un par galvánico es evitando que estén en contacto directo, por ejemplo, en los barcos fabricados en aluminio, las tomas de mar, que suelen ser de bronce o latón, están aisladas mediante una junta para evitar el contacto con el casco, aunque éste tenga también que tener un par de ánodos de sacrificio de zinc. Otro ejemplo muy común lo podemos ver en los tangones de pesca de alumnio, si nos fijamos, todos los tornillos y tuercas de acero inoxidable que arman los tangones no están en contacto directo con el aluminio, sino que van enfundados con pequeños tubos y arandelas de plástico para que no haya contacto.
Corrosión electrolítica:
Al igual que la corrosión galvánica, la corrosión electrolítica es un proceso electroquímico cuya diferencia con ésta radica en que la corriente no es producida por la diferencia de potencial entre dos metales, sino por una fuente de energía externa que puede provenir tanto de nuestro barco como de fuera de éste. Se las llama corrientes parásitas, siendo realmente fugas involuntarias de corriente. Es mucho mas agresiva que la galvánica, ya que las diferencias de potencial entre dos metales suele estar en torno a un voltio, mientras que las diferencias de potencial que produce la electrólisis pueden alcanzar valores desorbitados si la corriente parásita proviene por ejemplo, de una fuente de energía que genera 360 voltios.
Evitar fugas con una buena instalación
Los metales como el bronce, el acero o el aluminio son prácticamente homogéneos, pero existen, entre las zonas de un mismo metal, diferencias de potencial muy pequeñas, estas diferencias, no son capaces por si mismas de generar una corriente eléctrica importante bajo la acción de un electrolito, pero si incide una corriente sobre estos metales, éstos se polarizan y una parte hará de ánodo y otra de cátodo, con lo que se formará una célula galvánica que iniciará el proceso de corrosión.
Protección contra la corrosión electrolítica:
La mejor forma de protegernos contra la corrosión electrolítica es evitarla, ya que los medios de que disponemos o no son muy efectivos o son excesivamente caros. Por supuesto que una protección mediante ánodos de sacrificio impedirá que nuestro casco de alumnio, nuestras tomas de mar o nuestro eje de la hélice se corroan, pero si se da el caso tendremos que estar poniendo zincs cada mes a nuestro barco, ya que si la corriente parásita es importante se los comerá en un abrir y cerrar de ojos.
El sistema más eficaz para prevenir la corrisión electrolítica es instalar un circuito de corriente impresa, el problema, aparte de su excesivo coste, es que está pensado para grandes barcos con casco de acero y no para barcos de fibra de vidrio, en donde los elementos a proteger son mínimos. El sistema consiste en que un controlador va midiendo las diferencias de potencial entre las partes a proteger y un electrodo de zinc que le servirá de referencia, este voltaje lo contrarrestará con una «corriente impresa» que emite a través de unos ánodos inertes, que suelen ser de aleaciones de plomo, plata, titanio o platino, haciendo que las partes a proteger se conviertan en cátodos. El eje de la hélice y la mecha del timón también se ven beneficiados de la protección porque se conecta al casco del barco, este sistema actúa tanto contra la corrosión electrolítica como contra la galvánica, evitando los continuos cambios anuales de zincs.
Reparación de una hélice
Con un poco de cuidado podemos intentar evitar la corrosión, sólamente tenemos que pensar en cómo puede afectar este fenómeno a los dispositivos y elementos que instalemos para tomar las debidas precauciones, sólo así podremos prolongar la vida de nuestro barco, como la de los sistemas que lo componen.
Actuaciones para evitar las corrientes parásitas:
Interconectar todos los elementos metálicos de las sentinas, como prensaestopas, tomas de mar, etc. entre sí. Esto tiende a igualar sus potenciales, después, lo conectaremos a un ánodo de zinc destinado a tales elementos o a la mecha del timón, beneficiándonos del zinc que está instalado en la pala. Si hay un rápido deterioro de éste nos indicará que hay una corriente parásita.
Conectar todos los aparatos eléctricos , como las bombas de sentina a la toma de tierra, en este punto, se conectará también el negativo de las baterías, al igual que todos los elementos interconectados que comentamos en el punto anterior.
Conectar a la red de 12 voltios todos los aparatos eléctricos instalados en la sentina o en lugares donde puedan mojarse con conectores aislantes termorretráctiles que impidan cialquier fuga de corriente.
No poner ninguna toma de 220 voltios por debajo del nivel máximo de almacenamiento de agua de la sentina, por muy aislada que esté.
Para evitar que nos entre corriente por la toma de tierra del muelle, instalaremos un aislador galvánico en la toma de tierra de nuestro cargador de baterías. Si un barco o la propia instalación del muelle tienen una derivación hacia esta toma, la corriente entrará en todos los barcos que estén conectados a tierra.
En los barcos de aluminio usar una capa de pintura aislante sobre todo el casco, incluso en la obra muerta.
~ por belenos en diciembre 14, 2007.
Publicado en Barcos







Este articulo es un estracto del publicado este mes en la magnifica revista «Pesca a bordo», la que recomiendo comprar a todo buen aficionado a la pesca, muy buena y como veis con articulos realmente interesantes.
Muy buena informacion, me gustaria saber cuales fueron tus fuentes, la nota historica del experimento de la Armada Britanica es muy buena, pero principalmente sobre todos los cuidados de los metales en exposición a ambientes marinos. Gracias por tu atención y felicidades.
______________________________________________
El post está sacado de una articulo de una revista de pesca, que llegó a mi a través de un amigo, era la revista «Pesca a Bordo», me pareció una información interesante a tener en cuenta por todos aquellos que tengan una embarcación o interes en tenerla, por eso lo he publicado, para que esté al alcance de todos. He suprimido algunas cosas, tablas, esquemas de conexiones a tierra etc, que espero publicar en cuanto tenga tiempo en otro artículo. Gracias a ti por tus felicitaciones.
[…] Básicamente los podemos dividir en dos tipos: los de matriz dura y los autopulimentables. Ambos contienen biocidas orgánicos y algunos también compuestos a base de cobre que le confieren la propiedad de eliminar los microorganismos. Debemos tener en cuenta que en los barcos de aluminio no se pueden aplicar los antifouling que contengan cobre, ya que se puede producir corrosión galvánica entre estos dos metales. (Ver el post La corrosión, el talón de Aquiles de los metales). […]
Os invito a que visiteis la pagina http://www.keronite.com en su versión en castellano. En ella se dan detalles de como se puede transformar las primeras micras de aleaciones ligeras (aluminio, magnesio, titanio..) en ceramica, con lo que el efecto de la corrosión es mínimo. Podemos conseguir hasta 2000 horas en camara salina.
fome
excelente información.gracias.mey
me gustaría saber como tecniquita que soy , como puedo distinguir rápidamente (macroscopicamente) un metal de otro para ser ensayado a tracción o fatiga etc.agradeceré su ayuada.
Hola, me interesa mucho el tema de la protección contra corrosión de los barcos. Por favor podrías hacerme llegar el artículo de pesca a bordo del que se habla en los comentarios.
Gracias de antemano.
____________________________________________________
Lo siento, pero mi mujer haciendo limpieza en casa me tiró todas las revistas de pesca y navegación que tenía, con la consiguiente bronca posterior y el correspondiente arresto sin sexo durante una temporada…… lo normal, vaya….
yo quiero saber hacerca de las listas de los metales en mayor resistencia contra la corrocion galvanica
Mejor comprate un diccionario para no maltratar tanto el castellano.
MUY BUENO, TU ARTICULO… GRAX POR TOMARTE EL TIEMPO DE REDACTARLO…
hola tengo un barco de hierro o acero y esta presentando problemas de voltaje en el motor,cuando mido desde el motor contra el casco me da 12 volt,quisiera un plano de tierra para igualar los potenciales o que me digan como se hacen lAS CONECCIONES DE TIERRA EN EL BARCO,ya encontre la causa del voltaje pero me di cuenta que ninguno de los equipos incluyendo el motor tienen deribacion a tierra,es un velero de hierro 10mts y motor diesel,les agradeceria cualquier informacion o plano de tierra.
BUEN DIA, SOY ESTUDIANTE DE INGENIERIA NAVAL Y MI PROYECTO FINAL ES UNA OPTIMIZACION EN EL SISTEMA DE PROTECCIÓN CONTRA LA CORROSIÓN EN EMBARCACIONES DE ALUMINIO, ME GUSTARIA QUE ME AYUDARA EN LA BUSQUEDA DE INFORMACIÓN CON RESPECTO A LA CORROSION POR CORRIENTES PARASITAS Y LA CORROSION GALVANICA…MUCHAS GRACIAS
Lo siento mucho, pero mis conocimientos no creo que alcancen el nivel de un ingeniero naval ni de lejos…
Muy bueno el artículo. Felicitaciones. Formulo una pregunta a expensas de tus conocimientos: En barcos de aluminio las helices de bronce, así comlo los ptensaestopas (bocina) y grifos del fondo no conviene que sean de bronce y/o inoxidable, que materiales recomienda ? Y en caso de tener que contr con estos materiales, cual es la mejor solución ? Desde ya Gracias.
hola necesito realizar una exposicion y aunque ya tengo algo adelantado me gustaria ampliarlo, se trata de corrosion en bombas de agua.si pueden enviar fotografias ilustrativas seria buenisimo gracias.
boy arealisar unatarea un informe de experimento y llo escoji el deterioramiento de los metales si me pueden dar consejos como selos boi agradeser mi coreo es jose.azul30@yahoo.com
hola muy buen articulo amigo estoy estudiando el problema de la corrosion en barcos y m gustra ver si m puedes ayudar en informacion!! grax!!
Hay una empresa en San Sebastián que se dedica a este tema tanto para embarcaciones de recreo como para embarcaciones de pesca,hace 2 años tuve un problema muy gordo en mi barco y me lo solucionaron a la primera la empresa se llama tecnicmar y el tel.609145375